11 ) -Les mélanges - La dissolution - La séparation des constituants d'un mélange - Le corps pur et ses caractéristiques
I- Les mélanges
1- Définition d'un mélange
Un mélange est
formé de deux ou plusieurs constituants différents. Un mélange peut être formé
d’un liquide et d’un solide, d’un liquide et d’un gaz ou de deux liquides, il
peut être également formé des gaz.
2- Les types de mélanges
Il y a deux
sortes de mélanges : mélange homogène et mélange hétérogène.
• Un mélange
homogène est un mélange dont on ne peut distinguer à l'œil nu les différents
constituants. Exemples : eau de robinet, limonades, farine et sucre poudre….. •
Un mélange hétérogène est un mélange dont on peut distinguer à l'œil nu au
moins deux constituants. Exemples : eau et huile, eau et sable, eau et farine,
eau et terre…
3- Exemple de quelque mélanges
II- La dissolution
1- définition d'une solution aqueuse
- Une solution est un mélange homogène obtenu par
dissolution d’une espèce chimique (le soluté) dans un liquide (le solvant).
- Le soluté : est une espèce chimique destinée à se
dissoudre dans un solvant.
Il peut se présenter à l’état solide, liquide ou gazeux.
- Le solvant : Il s’agit du liquide dans lequel est dissous le soluté.
Solution = Solvant + Soluté |
Remarque:
Si le solvant
est l’eau, la solution est appelée solution aqueuse.
2- Les types des solutions
a-
activité expérimentale
On mélange l’eau
avec le sel selon les quantités suivantes :
b-
observation
On observe la
disparition du sel dans les tubes A et B , et la non disparition totale du sel
dans le tube C
c. Conclusion :
Selon les quantités de soluté, les solutions se divisent
en trois types :
Solution diluée : où une petite quantité du solvant se dissout
totalement dans l’eau.
Solution concentrée : où une grande quantité du solvant se dissout
totalement dans l’eau
Solution saturée : lorsque le
solvant ne peut pas faire dissoudre tous le soluté.
III- Séparation des constituants d'un
mélange
1- Séparation des constituants d'un mélange
hétérogène
1-1- La décantation
a - Séparation des constituants d’un mélange (liquide – solide)
On laisse reposer une eau
boueuse dans un récipient.
*Observation :
Les particules solides et lourdes se déposent au fond du
tube en formant un dépôt solide, celle plus légères
restent en surface.
Le liquide au-dessus du dépôt est plus clair.
*conclusion
La technique de décantation consiste à laisser reposer un
mélange hétérogène qui présente des couches
distinctes, puis
les séparer par transvasement .
b - Séparation deux
liquides non-miscible
On verse le mélange
d'eau et d'huile dans l'ampoule à décanter comme indiqué ci-dessous.
• Conclusion
Dans une ampoule à décanter, le liquide ayant la plus
grande masse volumique finit par occuper le fond de l’ampoule et le liquide de
petite masse volumique se place en haut de l’ampoule.
On utilise le robinet en bas pour récupérer tout d’abord
le liquide en bas. Puis ensuite on peut récupérer celui
du haut.
1-2- La
filtration
On verse le mélange décanté sur un papier filtre ( c'est
un papier qui contient des trous
microscopiques).
*observation
les particules solides sont bloquées par le filtre c’est
le résidu, seul le liquide peut passer.
*conclusion
Lors d’une filtration, les constituants solides d’un mélange
hétérogène sont retenus par le filtre.
Le liquide homogène obtenu est appelé filtrat.
2- Séparation des constituants d'un mélange
homogène
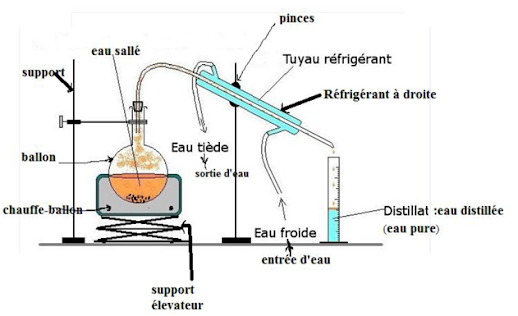
- La distillation
On réalise la
distillation de la solution homogène
Pour séparer les constituants d’un mélange homogène, on
procède à la distillation : c’est une évaporation suivie d’une condensation.
- Après la distillation, on obtient l’eau distillée ou
distillat.
- L’eau distillée se constitue que de l’eau, on dit c’est
.une eau pure
- L’eau pure est
un corps pur.
IV- Le corps pur et ses
caractéristiques
1-1- Température de l'eau distillée durant l'ébullition et la fusion
1-
à l’ébulition
Expérience :
On chauffe une
solution d'eau distillée ,et on enregistre la température au-bout de chaque
minute :
2-
au fusion
Expérience :
On chauffe une
glace d'eau distillée ,et on enregistre la température au-bout de chaque minute
:
Conclusion
:
- La température se stabilise pendant l'ébullition de
l'eau distillée à 100 ° C
et à 0 ° C pendant sa fusion.
- Tous les corps pur sont caractérisés par une
température d'ébullition
( ou
condensation) et une température de fusion(ou solidification) constante.
1-2- Température de l'eau salé durant l'ébullition
1-
à l’ébulition
Expérience :
On chauffe une
solution d'eau salée ,et on enregistre la température au-bout de chaque minute
:
2-
au fusion
Expérience :
On chauffe une
glace salée ,et on enregistre la température au-bout de chaque minute :
Observation et Conclusion
- Pendant la vaporisation
et la fusion la température continue à augmenter.
- Un mélange n'a
pas des degrés de température qui caractérise ses transformations d'état physique.